瓊脂糖凝膠電(diàn)泳實驗常見問題分(fēn)析
發布時間:
2024-01-15 15:07
瓊脂糖凝膠電(diàn)泳實驗常見問題分(fēn)析
瓊脂糖凝膠電(diàn)泳已經成為(wèi)一種分(fēn)析鑒定重組DNA分(fēn)子及蛋白質(zhì)與核酸相互作(zuò)用(yòng)的重要實驗手段,也是分(fēn)子生物(wù)學(xué)研究的重要方法,常用(yòng)于DNA分(fēn)型、鑒定DNA、RNA分(fēn)子混合物(wù)、DNA核苷酸序列分(fēn)析等技(jì )術,以瓊脂凝膠作(zuò)為(wèi)支持物(wù),利用(yòng) DNA 分(fēn)子在電(diàn)場中(zhōng)的電(diàn)荷效應和分(fēn)子篩效應,達到分(fēn)離混合物(wù)的目的。
現在我們一起了解一下瓊脂糖凝膠電(diàn)泳的工(gōng)作(zuò)原理(lǐ)和實驗中(zhōng)常見的問題和解決方法。
- 什麽是電(diàn)泳?
電(diàn)泳是一種利用(yòng)電(diàn)流根據DNA、RNA或蛋白質(zhì)的物(wù)理(lǐ)特性(如大小(xiǎo)和電(diàn)荷)來分(fēn)離它們的技(jì )術。
- 什麽是瓊脂糖?
瓊脂糖是一種線(xiàn)性多(duō)糖聚合物(wù),從紅色海藻産(chǎn)物(wù)瓊脂中(zhōng)提取而來。将瓊脂糖粉末加熱到熔點後冷切凝固便會形成良好的電(diàn)泳介質(zhì),其密度由瓊脂糖的濃度決定。
- 什麽是瓊脂糖凝膠電(diàn)泳?
瓊脂糖凝膠電(diàn)泳是一種電(diàn)泳形式,用(yòng)于根據核酸(DNA或RNA)片段的大小(xiǎo)進行分(fēn)離。當施加電(diàn)流時,帶負電(diàn)的DNA/RNA通過瓊脂糖凝膠的孔隙向凝膠帶正電(diàn)的一端遷移,較小(xiǎo)的片段遷移較快。由此産(chǎn)生的條帶可(kě)以用(yòng)紫外線(xiàn)(UV)光來觀察。
- 瓊脂糖凝膠電(diàn)泳實驗技(jì )巧和注意事項
- 瓊脂糖凝膠溶液配制時總液體(tǐ)量不宜超過錐型瓶50%容量。否則會溢出。
- 加熱過程中(zhōng)要不時搖動,使附于瓶壁上的瓊脂糖顆粒進入溶液。加熱時應蓋上封口膜,以減少水份蒸發。
- 注意不要損傷梳底部的凝膠。一個是在拔梳子的時候,一個是在加樣時。
- 凝膠濃度越低(非常脆弱且難以處理(lǐ)),分(fēn)辨的片段越大;凝膠濃度越高(很(hěn)脆且可(kě)能(néng)凝固不均勻),分(fēn)辨的片段越小(xiǎo)。所以在制膠的時候要特别注意。
- 瓊脂糖凝膠電(diàn)泳常見問題與異常分(fēn)析
Q1:為(wèi)什麽marker條帶非常模糊,無法辨别具(jù)體(tǐ)條帶?
A1:出現上述情況,可(kě)能(néng)有(yǒu)以下幾個原因:
1. marker條帶出現了降解。請确保在使用(yòng)過程中(zhōng)避免核酸酶污染;
2. 電(diàn)泳緩沖液陳舊。電(diàn)泳緩沖液多(duō)次使用(yòng)後,離子濃度降低,pH值上升,緩沖能(néng)力減弱,從而影響電(diàn)泳效果,建議經常更換電(diàn)泳緩沖液;
3. 電(diàn)泳條件不合适。電(diàn)泳時電(diàn)壓應不超過20V/cm,溫度應低于30℃;
4. marker上樣量過多(duō)。請根據說明書選用(yòng)合适上樣量;
5. 凝膠質(zhì)量不好。建議使用(yòng)質(zhì)量較好的瓊脂糖;此外,凝膠凝固不均勻也會導緻條帶模糊。
Q2:為(wèi)什麽marker條帶出現不規則的條帶(如啞鈴狀等)?
A2:出現上述情況,多(duō)與以下幾個原因有(yǒu)關:
1. 電(diàn)泳緩沖液陳舊。老化的電(diàn)泳緩沖液離子濃度降低,pH值上升,緩沖能(néng)力減弱,從而影響電(diàn)泳效果,建議經常更換電(diàn)泳緩沖液;
2. 電(diàn)泳條件不合适。電(diàn)泳時電(diàn)壓應不超過20V/cm,電(diàn)壓太高可(kě)能(néng)也會導緻marker條帶出現不規則現象。此外,凝膠質(zhì)量差以及凝膠冷卻時凝固不均勻也會導緻該現象出現。
Q3:為(wèi)什麽marker條帶非常弱或者根本沒有(yǒu)條帶?
A3:出現上述情況可(kě)能(néng)是:
1. marker上樣量較低,可(kě)适當增加上樣量;
2. 凝膠質(zhì)量較差或凝膠凝固不均勻也會導緻電(diàn)泳條帶弱或根本沒有(yǒu)條帶;
3. 電(diàn)泳時間過長(cháng)導緻marker條帶跑出凝膠,可(kě)縮短電(diàn)泳時間,降低電(diàn)壓,增加凝膠濃度。
Q4:為(wèi)什麽marker缺帶?
A4:對于含有(yǒu)較小(xiǎo)片段的marker,如果出現缺帶現象,可(kě)能(néng)是因為(wèi):
1. 小(xiǎo)條帶跑出凝膠或分(fēn)子量大小(xiǎo)非常相近的條帶不易辨認所緻,可(kě)适當縮短電(diàn)泳時間,降低電(diàn)壓,同時增加凝膠濃度;
2. 凝膠中(zhōng)染料含量過低,導緻大片段結合染料量太少或沒有(yǒu),在藍光儀下亮度太低,可(kě)适當增加染料用(yòng)量。
Q5:加樣孔出現熒光
1. 原因分(fēn)析:大片段DNA的滞留;
2. 解決方法:樣品出現溢出,應該通過降低模闆量或濃度來處理(lǐ);
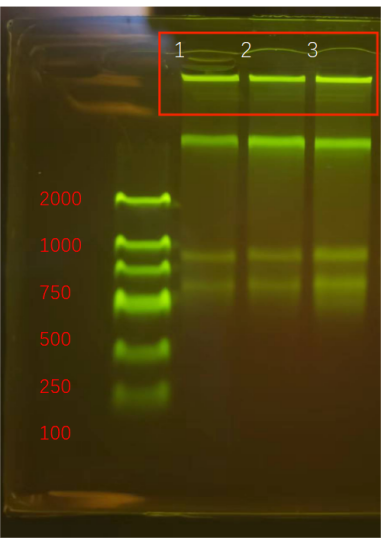
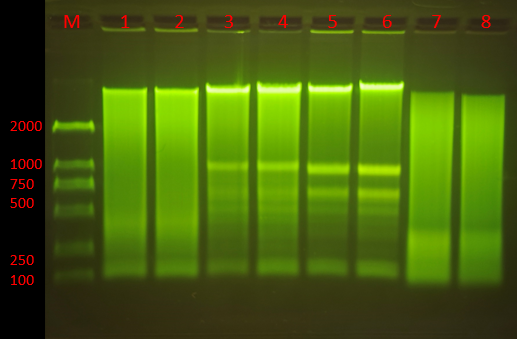
Q6:條帶模糊或彌散
1. 原因分(fēn)析:
(1)DNA發生降解;
(2)電(diàn)泳緩沖液陳舊;
(3)電(diàn)泳條件不合适;
(4)核酸樣品純度差,含有(yǒu)DNA結合蛋白或高濃度的鹽分(fēn);
(5)染色時間過長(cháng)或拍照前放置過久,DNA條帶彌散;
(6)PCR非特異性的擴增;
(7)加樣時操作(zuò)不當,樣品飄出樣孔;
2. 解決方法:
(1)更換緩沖液;
(2)根據凝膠大小(xiǎo)和電(diàn)泳緩沖液類型,使用(yòng)适當的電(diàn)壓進行電(diàn)泳;
(4)電(diàn)泳結束後及時觀察、拍照;
(5)DNA Maker進行對照,校正是否為(wèi)電(diàn)泳體(tǐ)系的問題;
(6)使用(yòng)特異性較高的引物(wù);
(7)降低電(diàn)泳時的上樣量,并小(xiǎo)心謹慎操作(zuò)實驗;
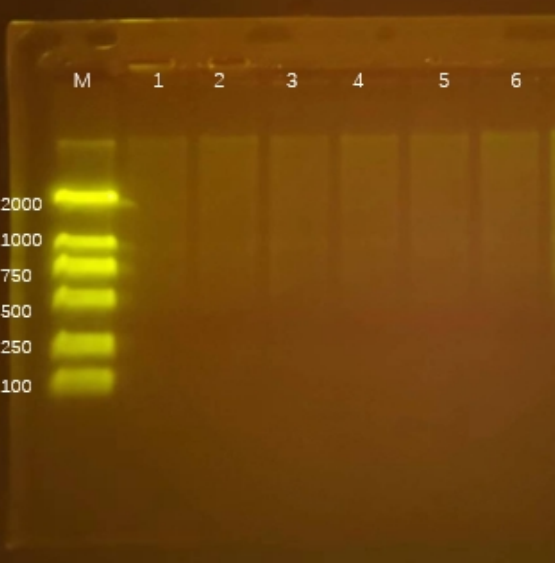
Q7:無條帶或者弱條帶
- 原因分(fēn)析:
(1)DNA的上樣量不夠;
(2)DNA發生降解;
2. 解決方法:
(1)增加上樣量;
(2)防止DNA降解,如:避免反複凍融樣品、避免核酸酶的污染。
Q8:DNA Marker降解
- 原因分(fēn)析:
- 核酸酶污染;
- 保存不當;
- 解決方法:
- 每次吸取時更換滅菌槍頭,勿将電(diàn)泳緩沖液帶入管中(zhōng)、用(yòng)後密閉4°C保存;
(2)4°C 或-20°C保存,避免多(duō)次反複凍融、不可(kě)加熱;
Q9:DNA Marker無正确分(fēn)離
- 原因分(fēn)析:
- 瓊脂糖質(zhì)量差;
- 電(diàn)泳緩沖液多(duō)次使用(yòng)後失效;
- 解決方法:
- 使用(yòng)質(zhì)量可(kě)靠的瓊脂糖制膠;
- 更換緩沖液;
Q10:條帶缺失
- 原因分(fēn)析:
- DNA條帶分(fēn)子量過大;
- 分(fēn)子量接近的DNA條帶沒有(yǒu)分(fēn)開;
- 電(diàn)泳緩沖液使用(yòng)不當;
- 電(diàn)泳時間過長(cháng)或電(diàn)壓過高,DNA走出凝膠
- 電(diàn)極插反,DNA走出凝膠
- 解決方法:
(1)使用(yòng)脈沖凝膠電(diàn)泳;
(2)選擇适當的凝膠濃度進行電(diàn)泳;
(3)SD和TBE緩沖液适于分(fēn)析較小(xiǎo)分(fēn)子量的核酸片段,大片段分(fēn)子不能(néng)完全分(fēn)離;TAE緩沖液不适于分(fēn)離很(hěn)小(xiǎo)的核酸片段;
(4)縮短電(diàn)泳時間,調整電(diàn)壓;
(5)正确連接電(diàn)極方向;
Q11:條帶大小(xiǎo)不正确
- 原因分(fēn)析:
- 核酸降解或形成聚合物(wù);
(2)λ DNA酶切Marker的cos位點複性;
(3)相同分(fēn)子量的核酸片段由于結構或序列的差異而有(yǒu)不同的遷移率;
(4)梳子變形,點樣孔不在同一水平線(xiàn)上;
2. 解決方法:
(1)加熱處理(lǐ)或重新(xīn)制備樣品;
(2)電(diàn)泳前65°C加熱5分(fēn)鍾,冰上冷卻5分(fēn)鍾以後再上樣;
(3)判斷核酸分(fēn)子是否有(yǒu)特殊結構,如缺口、超螺旋、二聚體(tǐ)等;富含AT堿基的DNA遷移率比同分(fēn)子量富含GC堿基的核酸片段慢;
(4)使用(yòng)完好的梳子制膠。
Q12:小(xiǎo)片段擴散,條帶模糊,粗
- 原因分(fēn)析:
- 錯誤選擇了低濃度凝膠,觀察大片段用(yòng)低濃度凝膠,觀察小(xiǎo)片段要用(yòng)高濃度;
- 瓊脂糖質(zhì)量不好,質(zhì)量不好的瓊脂糖分(fēn)離小(xiǎo)片段容易擴散,即使是使用(yòng)高濃度凝膠;
- 選擇了不合适的電(diàn)泳緩沖液 ;
- 解決方法:
- 比如觀察100bp的小(xiǎo)片段用(yòng)2%凝膠跑電(diàn)泳;
- 換用(yòng)質(zhì)量好的瓊脂糖;
- SD和TBE緩沖液适于分(fēn)析較小(xiǎo)分(fēn)子量的核酸片段,大片段分(fēn)子不能(néng)完全分(fēn)離;TAE緩沖液不适于分(fēn)離很(hěn)小(xiǎo)的核酸片段。
Q13:條帶偏移扭曲
- 原因分(fēn)析:
- 瓊脂糖凝膠配置出現問題;
- 凝膠未完全凝固;
- 凝膠在電(diàn)泳槽中(zhōng)位置擺放偏移;
- 解決辦(bàn)法:
- 應準确配置瓊脂糖凝膠,并充分(fēn)進行凝固;
- 應固定好凝膠在電(diàn)泳槽中(zhōng)的位置,避免電(diàn)泳過程中(zhōng)出現偏移;
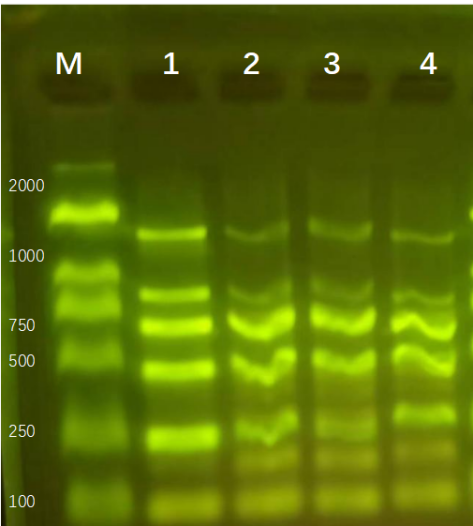
上海領駿自主研發的磁珠法核酸提取試劑,可(kě)以提取高質(zhì)量的核酸DNA/RNA,進行瓊脂糖凝膠電(diàn)泳,能(néng)夠得到清晰、明亮、完整的條帶,并且操作(zuò)簡單快速,整個流程基本分(fēn)為(wèi)(裂解結合、洗滌、幹燥、洗脫),大多(duō)數10-30min内即可(kě)完成。可(kě)針對血液、血清/血漿、唾液、細菌、真菌、拭子、糞便、動植物(wù)組織、中(zhōng)草(cǎo)藥、石蠟包埋組織、PCR産(chǎn)物(wù)、測序反應産(chǎn)物(wù)等樣本,分(fēn)離純化高質(zhì)量基因組DNA/RNA、cfDNA、ctDNA或病毒核酸。
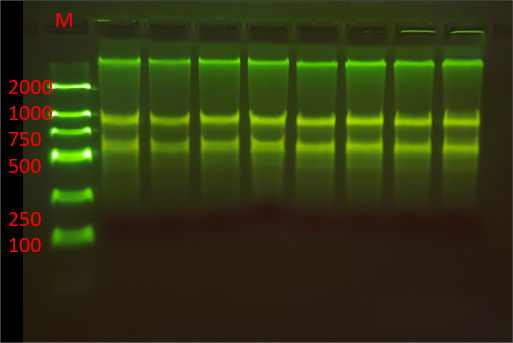
圖 新(xīn)鮮yan葉DNA/RNA提取電(diàn)泳圖
歡迎咨詢、采購(gòu)!
推薦新(xīn)聞




